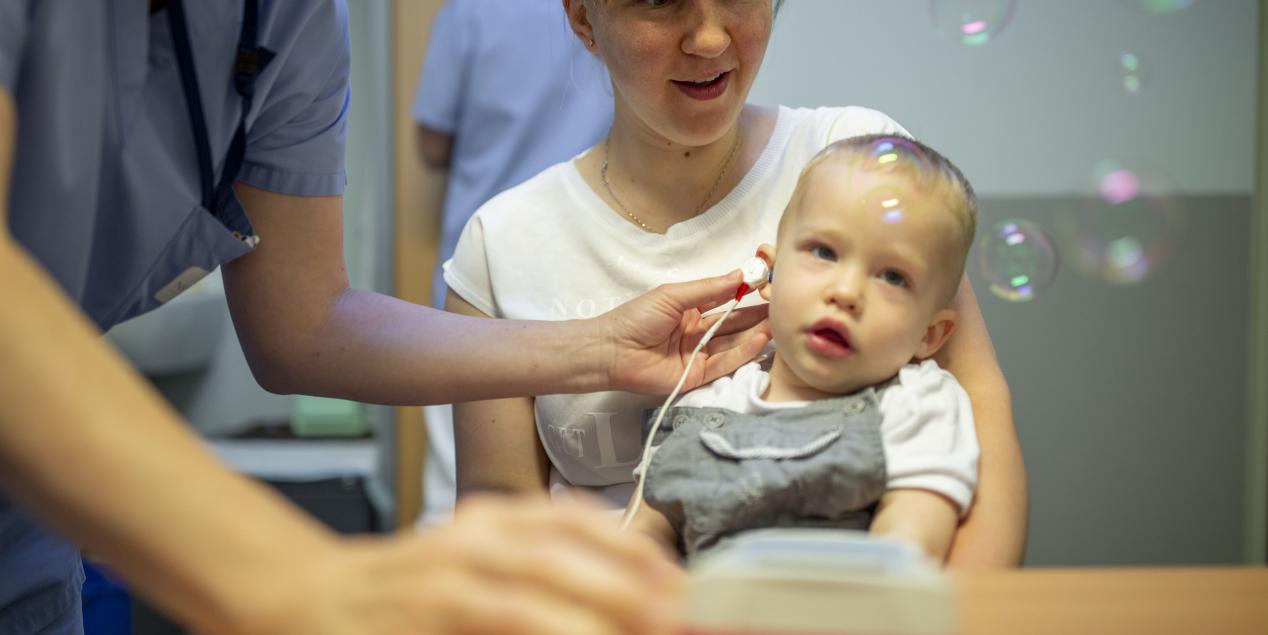
La surdité DFBN9 est une maladie génétique rare. La surdité est toujours bilatérale et, le plus souvent profonde dès la naissance mais peut aussi s'aggraver progressivement dans le temps (Yasunaga et al., 1999)
Le gène responsable de cette surdité, appelé OTOF, découvert par l’équipe du Pr Christine Petit à l’Institut Pasteur, code pour la protéine otoferline. L’otoferline est essentielle à la transmission de l’information sonore au niveau des synapses des cellules sensorielles de l’organe de l’audition, qui sont les cellules ciliées internes (Roux et al., 2006). Ce type de surdité est une neuropathie auditive, et plus précisément, il s’agit d’une synaptopathie. Les synapses sont les points de contact entre les cellules ciliées internes et les neurones du nerf auditif. En dehors de l'anomalie de la transmission synaptique, le reste de la cochlée fonctionne parfaitement.
Génétiquement, il existe deux types d'anomalie du gène OTOF :
- Soit la mutation altère totalement la production de la protéine otoferline entraînant chez les sujets une surdité sévère à profonde (la majorité des cas observés)
- Soit la mutation permet la fabrication d'une protéine otoferline partiellement fonctionnelle entraînant une surdité moyenne, fluctuante, mais avec d'importantes difficultés de compréhension de la parole et d'acquisition du langage oral. Le déficit auditif peut s'aggraver lors d'épisodes de fièvre.
La surdité DFNB9, ou perte d’audition liée à un déficit en otoferline, représente environ 5% des cas de surdités à la naissance et touche entre 3 à 5 enfants sur 100 000 (Vona et al., 2020). Chaque gène de notre organisme est présent en 2 copies : une qui vient du père et l’autre de la mère. Dans le cas de la surdité DFNB9, les 2 parents normoentendants transmettent chacun à leur enfant une copie du gène OTOF muté dont ils sont porteurs.
Diagnostic
Le diagnostic de la surdité DFNB9 doit être effectué par un centre référent d’ORL pédiatrique. Le diagnostic repose sur des tests audiométriques de type potentiels évoqués auditifs (PEA), potentiels stationnaires (ASSR), otoémissions acoustiques (OEA) et une audiométrie tonale et, si possible, vocale. L’analyse génétique cherche une anomalie au niveau du gène OTOF chez l’enfant et les 2 parents pour confirmer le diagnostic de surdité DFNB9.
Prise en charge thérapeutique
A ce jour, il n’existe pas de traitement curatif des surdités neurosensorielles et en particulier de la surdité DFNB9.
La prise en charge des surdités repose sur l’utilisation de dispositifs audioprothétiques (appareillage auditif conventionnel ou implant cochléaire en fonction du degré de sévérité de la perte auditive) accompagnée d’une rééducation orthophonique précoce et intensive visant à développer le langage et la réhabilitation auditive avec apprentissage de la lecture labiale. La sévérité et la précocité de la surdité vont conditionner l’apprentissage du langage oral et ses retentissements sociaux, scolaires et cognitifs.
Appareillage auditif conventionnel
L’appareillage auditif conventionnel vise à amplifier le signal sonore afin d’améliorer la perception auditive. Il est proposé en cas de surdité bilatérale légère à moyenne de type DFNB9. L’appareil doit être mis en place de manière précoce, dès le diagnostic de la perte auditive. Il est important de faire appel à des audioprothésistes spécialisés dans la prise en charge des surdités de l’enfant. La prise en charge audioprothétique inclut le choix et l’adaptation des prothèses, le contrôle d’efficacité, le suivi, ainsi que l’éducation prothétique. Le port régulier de l’appareil est encouragé pour optimiser les résultats.
Implantation cochléaire
Pour la plupart des patients diagnostiqués précocement avec une surdité DFNB9 profonde, la pose d’implant cochléaire est proposée aux familles ayant opté pour un projet de communication orale.
En cas de surdité moyenne, l’indication d’implantation cochléaire peut être portée si la compréhension des mots est faible.
La proposition d’implantation est effectuée après un bilan pluridisciplinaire (clinique, audiométrique subjectif et objectif, vestibulaire, radiologique, orthophonique, psychologique) réalisé dans un centre spécialisé.
L’implantation peut être unilatérale ou bilatérale, simultanée ou séquentielle en fonction de l’atteinte auditive, de l’âge du patient et du choix de la famille. En cas d’implantation unilatérale, il est important d’encourager le port de la prothèse auditive sur l’autre oreille, une implantation pourra être proposée secondairement.
Dans la surdité DFNB9, les résultats de l’implantation cochléaire sont bons tant du point de vue perceptif qu’expressif (Rouillon et al., 2006; Zheng and Liu, 2020). Comme pour toutes implantations cochléaires, les résultats dépendent de l’âge d’implantation, de la rééducation orthophonique et de l’accompagnement familial (Zheng and Liu, 2020). Globalement, la grande majorité des personnes implantées ont une bonne compréhension dans le silence. En revanche, une conversation dans le bruit ou la perception de la musique seront plus difficiles.
Rééducation orthophonique
La rééducation orthophonique constitue une part importante de la prise en charge.
La rééducation doit débuter dès le début de la réhabilitation auditive. Les objectifs sont le développement du langage oral : éducation auditive au monde sonore de façon ludique, développement des capacités d’expression de l’enfant et encouragement de l’expression de l’enfant en français parlé lors des activités de la vie quotidienne. Le nombre de séances hebdomadaires est évalué par l’orthophoniste. En cas d’implantation cochléaire, la rééducation orthophonique doit être poursuivie après l’activation de l’implant afin d’obtenir une amélioration progressive de l’intelligibilité des patients.
Futures thérapies
Des équipes de recherche développent des essais de thérapie génique afin de restaurer l'audition chez les enfants avec un déficit en otoferline. Concrètement, une copie du gène normal de l'otoferline est injectée au niveau de l'oreille interne déficiente des enfants.
Quatre médicaments de thérapie génique sont en phase de test pour la surdité DFNB9 :
- Médicament SENS-501 de la société de biotechnologie française Sensorion testé en France (Essai Audiogene).
- Médicament du laboratoire pharmaceutique chinois Shanghai Refreshgene Therapeutics testé en Chine.
- Médicament DB-OTO du laboratoire pharmaceutique américain Regeneron Pharmaceuticals testé en Angleterre et aux USA.
- Médicament AK-OTOF du laboratoire américain Eli Lilly testé aux USA.
En savoir plus sur les essais cliniques menés sur les troubles auditifs.
Pour tout renseignement sur l’essai Audiogene, contactez : secretariat.loundon.nck@aphp.fr
Rouillon, I., Marcolla, A., Roux, I., Marlin, S., Feldmann, D., Couderc, R., Jonard, L., Petit, C., Denoyelle, F., Garabédian, E.N., Loundon, N., 2006. Results of cochlear implantation in two children with mutations in the OTOF gene. Int. J. Pediatr. Otorhinolaryngol. 70, 689–696. https://doi.org/10.1016/j.ijporl.2005.09.006
Roux, I., Safieddine, S., Nouvian, R., Grati, M., Simmler, M.-C., Bahloul, A., Perfettini, I., Le Gall, M., Rostaing, P., Hamard, G., Triller, A., Avan, P., Moser, T., Petit, C., 2006. Otoferlin, defective in a human deafness form, is essential for exocytosis at the auditory ribbon synapse. Cell 127, 277–289. https://doi.org/10.1016/j.cell.2006.08.040
Vona, B., Rad, A., Reisinger, E., 2020. The Many Faces of DFNB9: Relating OTOF Variants to Hearing Impairment. Genes 11, 1411. https://doi.org/10.3390/genes11121411
Yasunaga, S., Grati, M., Cohen-Salmon, M., El-Amraoui, A., Mustapha, M., Salem, N., El-Zir, E., Loiselet, J., Petit, C., 1999. A mutation in OTOF, encoding otoferlin, a FER-1-like protein, causes DFNB9, a nonsyndromic form of deafness. Nat. Genet. 21, 363–369. https://doi.org/10.1038/7693
Zheng, D., Liu, X., 2020. Cochlear Implantation Outcomes in Patients With OTOF Mutations. Front. Neurosci. 14, 447. https://doi.org/10.3389/fnins.2020.00447
F.A.Q - Audiogene, le premier essai clinique de thérapie génique sur la surdité DFNB9 en France
La surdité DFNB9 est une atteinte auditive d'origine génétique, rare. En règle générale, il s'agit d'une surdité congénitale, c'est-à-dire présente dès la naissance. C'est une surdité héréditaire, impliquant une transmission à l'enfant par chacun des deux parents.
« Elle est le résultat de l’inactivation fonctionnelle des deux copies du gène OTOF, qui sont présentes chez tout individu. L’enfant qui a reçu deux copies altérées du gène OTOF, l’une transmise par son père et l’autre par sa mère, est atteint de surdité. Les parents qui possèdent une copie altérée et une copie normale du gène OTOF n'ont aucun trouble de l'audition. Ce gène est l'un des tout premiers gènes responsables que nous avons découverts dans notre laboratoire de l'Institut Pasteur et dont nous avons mis au jour son rôle essentiel dans les cellules sensorielles auditives de l'oreille. Dans l'exploration de cette surdité chez le tout-petit, certains examens audiologiques permettent de suspecter que le gène OTOF en est responsable, mais seul le diagnostic moléculaire qui met en évidence une altération de ce gène permet de l'authentifier ».
Christine Petit, professeure à l'Institut Pasteur, professeure émérite au Collège de France et responsable du laboratoire d'innovation en thérapies de l'audition à l’Institut de l’Audition, centre de l’Institut Pasteur.
« La protéine otoferline est responsable du trafic de l’information entre les cellules ciliées internes et la terminaison nerveuse dans l’oreille interne. Quand il n’y a pas d’otoferline, l’information sonore va aller jusqu’à l’oreille interne mais ne sera pas transférée au nerf auditif. Ces enfants là ont une surdité qui peut être légère, moyenne, sévère, profonde. »
Natalie Loundon, directrice du Centre de Recherche en Audiologie Pédiatrique, oto-rhinolaryngologiste pédiatrique et chirurgien de la tête et du cou, Hôpital Necker-Enfants malades - AP-HP, à l'initiative de l'étude clinique Audiogene.
AU QUOTIDIEN ?
Témoignage de Nathalie L., mère de Louna, présentant une surdité DFNB9 :
« Louna a besoin de lire sur les lèvres et cela demande énormément de concentration. Actuellement, ça va, elle grandit, mais quand elle était plus petite, Louna était épuisée, tellement cela demandait d’efforts. »
Témoignage de Clara B., touchée également par cette surdité : « Le plus difficile au quotidien, ce sont les discussions en groupe ou dès qu’il y a trop de bruit environnant. Je suis perdue car tout le monde parle en même temps. C'est compliqué à gérer. J'utilise toujours la lecture labiale en support, mais c'est fatigant. »
Le diagnostic de la surdité DFNB9 repose en premier lieu sur des tests audiométriques. En cas de suspicion, une analyse génétique du gène OTOF chez l’enfant et les 2 parents est réalisée pour confirmer le diagnostic de surdité DFNB9. On ne fait pas de recherche de mutation du gène OTOF systématiquement.
Le processus de dépistage, de diagnostic et de prise en charge génétique d'un enfant présentant une surdité congénitale comprend trois grandes étapes :
Dépistage et diagnostic précoce :
- Dès la naissance, un dépistage néonatal est proposé aux parents après 24 heures de vie du nouveau-né, conformément à une réglementation datant du 3 novembre 2014.
- En cas de résultats non concluants ou pour vérification, un second diagnostic peut être réalisé avant la sortie de la maternité avec le consentement des parents.
- Pour la surdité DFNB9, le diagnostic peut être complexe car le test d'émissions oto-acoustiques (EOA), souvent utilisé pour dépister les troubles auditifs, peut être normal chez ces enfants. Les potentiels évoqués automatisés (PEA) sont nécessaires pour confirmer la surdité.
(!) Les émissions oto-acoustiques testent la réponse des cellules ciliées externes de la cochlée, qui fonctionnent normalement dans la surdité DFNB9. Cependant, les cellules ciliées internes ne fonctionnent pas, entraînant une surdité profonde. Lorsque les tests d'EOA sont positifs, on ne réalise généralement pas de PEA. Le choix entre les deux tests pendant le dépistage néonatal est souvent dicté par des considérations budgétaires.
Consultation d’un médecin généticien :
En cas de diagnostic de surdité confirmé, l'étape suivante consiste à consulter un médecin généticien.
Exploration génétique et historique familial :
- Le généticien mène une exploration approfondie du profil et de l'historique familial.
- En fonction de chaque cas, différents tests génétiques sont proposés pour identifier les causes possibles de la surdité. Fréquemment, le gène GJB2 est examiné, représentant 20 % des cas de surdité congénitale en France.
- En cas de résultat normal pour le gène GJB2, une analyse plus approfondie est effectuée sur d'autres gènes, notamment OTOF.
- L’analyse génétique cherche une anomalie au niveau du gène OTOF chez l’enfant et les 2 parents pour confirmer le diagnostic de surdité DFNB9.
(!) Parmi les surdités congénitales, 80 % ont une origine génétique. Dans cette catégorie, dans 90 % des cas l'anomalie du gène est responsable uniquement d'une surdité qu'on nomme surdité isolée. Pour les 10 % restants, la surdité est associée à d'autres symptômes.
L’EXPERIENCE DE LA FAMILLE B.
Laurent B. (le père) : « Il a été très compliqué d’arriver à un diagnostic de la surdité DFNB9 pour Clara. Nous avons effectué des tests ORL classiques chez un audioprothésiste en lien avec le pédiatre, mais nous ne trouvions pas de surdité, du moins, aucun problème n'était détecté. Nous avons erré pendant des années et la différence dans le développement du vocabulaire de Clara devenait de plus en plus évidente par rapport à ses sœurs. »
Laurent B. (le père) : « C’est vers les 8 ans de Clara qu'un nouvel ORL est arrivé dans notre ville et nous a suggéré de réaliser un PEA (potentiel évoqué auditif). Jusqu'à ce moment, aucun médecin, ORL ou pédiatre n’avait demandé un PEA. Le résultat du PEA de Clara n'était pas concluant. »
Laurent B. (le père) : « Malgré ce test, le diagnostic n'était pas encore précis. Des tests génétiques ont été réalisés sans succès. Vers les 17 ans de Clara, de nouveaux tests génétiques ont été effectués, montrant une évolution par rapport à la première fois. Et à ce moment-là, le diagnostic de surdité DFNB9 a été confirmé. »
Laurent B. (le père) : « La difficulté pour parvenir à ce diagnostic réside également dans le fait que les tests n'étaient jamais constants, dépendant de la forme de Clara. Selon l’ORL, les capacités auditives diminuent après un entraînement sportif en raison de la fatigue. »
« La prévalence de la surdité génétique DFNB9 en France peut être estimée comme suit :
- La surdité DFNB9 touche approximativement 1 à 3 % des enfants sourds à la naissance.
- En France, avec environ 700 000 naissances annuelles, la prévalence des surdités est d'environ 1 pour 1000, ce qui équivaut à environ 700 enfants sourds par an.
- En considérant la fourchette de 1 à 3 % pour la surdité DFNB9, cela signifie que chaque année, environ 21 enfants naissent avec une surdité DFNB9.
En réalité, on estime une dizaine de naissances d’enfants porteurs d’une surdité génétique DFNB9 en France. »
Sandrine Marlin, médecin généticienne, directrice du Centre de Référence des Surdités Génétiques à l’Hôpital Necker-Enfants malades - AP-HP à Paris
Dans le cas d’une surdité DFNB9, aujourd’hui, on propose un appareil auditif lorsque la surdité est partielle et lorsque la surdité est sévère à profonde, on propose alors un implant cochléaire.
« Il n’y a, à ce jour, aucun traitement curatif des surdités neurosensorielles, c’est à dire dues à une atteinte de la cochlée ou des voies auditives. En parallèle d’une prise en charge multidisciplinaire, orthophonique, ORL, psychologique, éducative, l’audition de ces enfants est réhabilitée actuellement par implant cochléaire pour les formes de surdité sévères-profondes ou appareillage auditif pour les atteintes moins importantes. La réhabilitation apporte beaucoup à ces enfants mais la prise en charge reste lourde. »
Françoise Denoyelle, cheffe du service ORL, à l’Hôpital Necker-Enfants malades - AP-HP à Paris
QU’EN DISENT LES PERSONNES IMPLANTÉEES ?
Clara B. : « La transition avec l'implant cochléaire a été complexe, l'adaptation était difficile, car c’est un gros changement d’entendre une voix naturelle puis d’entendre une voix de robot. Auparavant, j'avais des appareils auditifs pendant deux ans, mais les bénéfices étaient limités. Je ne ressentais pas vraiment d'effet, donc je préférais les enlever. Après un an, avec plusieurs suivis et réglages, j’ai pu remarquer l'efficacité de l'implant sur moi. »
Clara B. : « J'avais des difficultés avant l'implant. Je n’osais pas aller vers les autres car je savais que je n'allais pas comprendre. Maintenant, après l'implant, ça m'a beaucoup aidée, je vais plus facilement vers les autres. »
Clara B. : « On m'a déjà proposé de faire un second implant cochléaire sur mon autre oreille, mais j'ai refusé. L’implant ne donne pas une audition naturelle, surtout quand j'écoute de la musique ! J'ai l'espoir dans la thérapie génique, donc pour le moment, je garde mon implant du côté droit. »
Louna R. : « On m'avait dit que je pourrais perdre l'audition au fil des années et j'ai réalisé qu'il serait dommage de ne pas pouvoir mieux entendre un jour. Finalement, j’ai changé d’avis. J'ai rencontré une fille qui avait des implants aux deux oreilles et ça m’a un peu aidée. Pour ma part, je me suis faite implanter seulement du côté droit. »
Louna R. : « Pouvoir entendre change vraiment la vie. Moi, personnellement, il y a des choses que je n'entendais pas, mais qu'aujourd'hui j'entends. Et je suis très contente parce que je me dis que là, je ne regrette pas aujourd'hui. Par contre, il y a des choses que je n'assume pas au niveau de l’implant, et j'en suis consciente. Mais je me dis qu'avec le temps, je vais finir par assumer. »
« La thérapie génique est définie* comme "une technique qui modifie les gènes d'une personne pour traiter ou guérir une maladie". Ces techniques ne cessent de se diversifier et leurs applications de s'étendre. Dans le cadre de cet essai clinique, le produit thérapeutique conçu et testé au laboratoire est une séquence d'ADN dérivée du gène OTOF à partir de laquelle une protéine, l'otoferline, sera produite. Cette séquence d'ADN doit être introduite dans les cellules cibles de l'atteinte qui doivent être traitées, les cellules sensorielles de l'organe sensoriel auditif, la cochlée. L'ADN thérapeutique va en quelque sorte prendre le relais des copies défectueuses du gène OTOF présentes chez le patient ; on parle de "thérapie génique de remplacement". Pour que cette séquence d'ADN puisse pénétrer dans ces cellules, elle est insérée dans un vecteur qui sera introduit dans la cochlée. Dans le cas présent comme dans la plupart des thérapies géniques actuelles, ce vecteur est un virus inoffensif et non pathogène."
En savoir plus sur le fonctionnement de le la thérapie génique (en vidéo)
* Définition donnée par l'agence américaine FDA (Food and Drug Administration) qui surveille la qualité des médicaments et accorde ou non l'autorisation de leur commercialisation sur le territoire américain.
« Chaque essai clinique exige la démonstration incontestable d'une preuve de concept, souvent réalisée au moyen de modèles murins reproduisant fidèlement la pathogénie à traiter. C'est précisément ce que mes collaborateurs et moi avons accompli dans le cadre de l'essai clinique visant à traiter par thérapie génique la surdité DFNB9, causée par une mutation du gène OTOF, codant pour la protéine otoferline.
Nous avons créé et caractérisé un modèle murin dépourvu d'otoferline, reproduisant fidèlement les caractéristiques de la surdité DFNB9. Ensuite, nous avons entrepris une approche de thérapie génique visant à restaurer l'expression de l'otoferline en introduisant une copie saine du gène OTOF au sein des cellules défectueuses de la cochlée.
Afin que cette thérapie génique soit applicable à l'humain, il était impératif de démontrer qu'elle pouvait inverser le phénotype (l’ensemble des traits observables) de surdité dans le modèle préclinique. C'est précisément ce que nous avons réussi à démontrer : un modèle murin atteint de surdité profonde, traité à l'âge de 30 jours, a retrouvé une audition normale trois semaines après l'administration du gène thérapeutique. »
Saaid Safieddine, chef d’équipe à l'Institut de l'Audition, centre de l'Institut Pasteur.
« Il est nécessaire, pour mettre en marche ce type d’essai complexe et innovant de réunir différents éléments complémentaires. En premier lieu, il a fallu obtenir des données précliniques en faveur d’un potentiel de sécurité et d’efficacité de la thérapie génique de l’otoferline délivrée par un double vecteur AAV.
Il a également fallu développer une procédure chirurgicale optimale, basée sur la chirurgie de l’implantation cochléaire, ainsi qu’un système d’injection permettant une administration dans l’oreille interne. Nous avons également recruté des experts du développement clinique et réglementaire spécialisés en thérapie génique.
Nous menons également à travers l’Europe une étude d’histoire naturelle qui permet non seulement de documenter l’évolution naturelle de la maladie et de définir des critères d’évaluations pertinents et cliniquement significatifs, mais aussi d’identifier de potentiels patients pour l’essai clinique Audiogene. »
Nawal Ouzren, Directrice de la biotech Sensorion
« Il a fallu d’abord identifier les éléments les plus pertinents du produit de thérapie génique qui permettent de cibler les bonnes cellules de l’oreille interne, c’est‐à‐dire celles qui expriment habituellement l’otoferline. Il s’agit de l’enveloppe du vecteur, et des séquences régulatrices qui permettent l’expression du gène codant pour l’otoferline. Comme ce gène est trop grand pour être contenu dans un seul vecteur, nous utilisons 2 vecteurs. Par un système de recombinaison, la protéine otoferline entière peut être reconstituée dans les cellules cibles. Selon un processus classique de production basé sur l’utilisation de cellules productrices de vecteurs, nous produisons chaque vecteur indépendamment. Les 2 vecteurs sont ensuite mélangés à un ratio 1/1 pour produire le produit final de thérapie génique SENS‐501. »
Nawal Ouzren, Directrice de la biotech Sensorion
« Des expérimentations ont été réalisées sur des modèles murins de la surdité DFNB9 afin d'évaluer la réponse à différentes doses et l'efficacité à long terme du vecteur thérapeutique humain. »
Et pour l’administration du médicament dans l’oreille interne :
« Dans le but d’améliorer l’administration du médicament, le consortium a exploré diverses voies d’injection intracochléaire et techniques chirurgicales. De plus, un dispositif médical d’administration a été mis au point pour optimiser le processus. »
Saaid Safieddine, chef d’équipe à l'Institut de l'Audition, centre de l'Institut Pasteur.
Par ailleurs, des études précliniques réglementaires de toxicité et de biodistribution ont été réalisées. Le produit est bien toléré, son profil de sécurité est satisfaisant. En conclusion, la balance bénéfice/risque est considérée comme favorable pour le patient; et l’essai clinique a obtenu les autorisations nécessaires pour démarrer, notamment en France.
Le médicament de thérapie génique SENS-501 sera injecté directement dans l’oreille interne de l’enfant avec une surdité DFNB9. Cette injection se fait au niveau de la fenêtre ronde de l’oreille interne de façon similaire à la chirurgie pratiquée pour l’implantation cochléaire. L’intervention est réalisée sous anesthésie générale et par un chirurgien ORL référent.
Le médicament est administré à l’aide d’un système d’injection, développée en partenariat avec la société EVEON, pour maîtriser précisément la dose injectée et préserver les structures de l’oreille interne.
« C’est un organe très petit et délicat qui est enchâssé dans l’os temporal – il est donc très difficile d’accès. Nous avons évalué, avec EVEON, les moyens permettant d’optimiser l’administration de produits dans l’oreille pour en maximiser son efficacité et son innocuité, pour une application dans le cadre de nos programmes de thérapie génique. »
Nawal Ouzren, Directrice de la biotech Sensorion
Pour qu’un gène pénètre dans les cellules de l’oreille interne, il doit être transporté par un vecteur viral capable de traverser la membrane des cellules. Les médicaments de thérapie génique développés aux Etats-Unis, en Chine ou en France pour la surdité DFNB9 diffèrent les uns des autres, notamment sur la partie du vecteur viral. Pour chaque nouveau médicament, un essai clinique doit être conduit.
Audiogene a été développé, avec le soutien de la Fondation Pour l'Audition, par un consortium français qui regroupe des équipes de l’Institut de l’Audition, centre de recherche de l’Institut Pasteur, du service ORL et du Centre de Recherche en Audiologie pédiatrique de l’hôpital Necker-Enfants malades - AP-HP ainsi que la Biotech Sensorion et de la Fondation Pour l’Audition.
Ce travail a été soutenu par l’Agence Nationale de la Recherche qui finance le programme France 2030 nommé RHU AUDINNOVE, ANR-18-RHUS-0007.
Contribution de la Fondation Pour l'Audition à l’essai Audiogene depuis 2019 :
-> Soutien aux équipes de l’Institut de l’Audition et plus particulièrement aux équipes de Christine Petit et Saaid Safieddine qui ont :
- Démontré le rôle fondamental de l’otoferline dans la transmission de l’information entre cellules ciliées et neurones auditifs
- Établit la preuve de concept pour la thérapie génique de l’otoferline chez l’animal.
- Mis au point le vecteur-médicament pour les phases précliniques chez l'animal
- Conduit les expérimentations complémentaires nécessaires au passage de la thérapie génique de l’animal à l’homme requises par l’agence du médicament (tests de la procédure chirurgicale et de l'injection).
-> Soutien au Centre de Recherche en Audiologie pédiatrique de l’hôpital Necker-Enfants malades - AP-HP dirigé par le Dr Natalie Loundon qui :
- Conduit l’étude de l’histoire naturelle de la maladie afin de mieux la caractériser
- Conduit les tests audiométriques sur la cohorte de patients DFNB9
- Coordonne l’essai clinique Audiogene
- Assure le suivi des enfants traités dans le cadre de l’essai Audiogene
-> Soutien au Centre de Référence des Surdités Génétiques de l’hôpital Necker-Enfants malades AP-HP (composante du Centre de Recherche en Audiologie pédiatrique Necker) dirigé par le Dr Sandrine Marlin qui conduit les analyses génétiques visant à diagnostiquer la surdité DFNB9 et à identifier des enfants éligibles à l’essai.
Les enfants prévus dans l’étude sont des nourrissons entre 6 et 31 mois d’âge ayant une surdité sévère à profonde, bilatérale, liée à une mutation dans le gène OTOF et candidats à un implant cochléaire. La thérapie génique serait proposée en alternative à l’implant cochléaire.
L'essai clinique Audiogene est conduit par la société de biotechnologie française Sensorion. Il est coordonné par la Dr Natalie Loundon, du service d'Oto-rhino-laryngologie et chirurgie cervicofaciale pédiatrique de Hôpital Necker-Enfants Malades AP-HP, 149 rue de Sèvres 75015 Paris.
Pour tout renseignement sur l’essai Audiogene, contactez : secretariat.loundon.nck@aphp.fr
« Le suivi sera organisé dans le centre de Recherche en Audiologie pédiatrique de l'hôpital Necker en suivant rigoureusement le cadre du protocole Audiogene, avec des bilans d’audition réguliers dont le rythme et la nature ont été prédéfinis. »
Françoise Denoyelle, cheffe du service ORL, Hôpital Necker-Enfants malades - AP-HP/Directrice des CreAs